绪论 单元测试
1、 问题:以下化学的分支学科中,哪一个是化学学科的理论核心?( )
选项:
A:无机化学
B:有机化学
C:物理化学
D:分析化学
答案: 【
物理化学
】
2、 问题:有机化学可以被称为“碳的化学”,研究碳氢化合物及其衍生物。( )
选项:
A:对
B:错
答案: 【
对
】
3、 问题:
空气质量报告中污染物的定性和含量测定都属于分析化学的范畴。( )
选项:
A:对
B:错
答案: 【
对
】
第一章 单元测试
1、 问题:热和功是状态函数。( )
选项:
A:对
B:错
答案: 【
错
】
2、 问题:体系和环境的划分是相对的。( )
选项:
A:对
B:错
答案: 【
对
】
3、 问题:
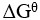 =0,意味着体系处于平衡态。( )
=0,意味着体系处于平衡态。( )
选项:
A:对
B:错
答案: 【
错
】
4、 问题:一个反应的ΔG值越负,其自发进行的倾向越大,反应速率越快。( )
选项:
A:对
B:错
答案: 【
错
】
5、 问题:在298K时,Mg的熵为零。( )
选项:
A:对
B:错
答案: 【
错
】
6、 问题:熵增反应是自发反应。( )
选项:
A:对
B:错
答案: 【
错
】
7、 问题:热力学第一定律是公理。( )
选项:
A:对
B:错
答案: 【
对
】
8、 问题:ΔG < 0,反应自发进行。( )
选项:
A:对
B:错
答案: 【
错
】
9、 问题:
U和ΔU都是状态函数。( )
选项:
A:对
B:错
答案: 【
错
】
10、 问题:任何过程的熵就是该过程的热温商。( )
选项:
A:对
B:错
答案: 【
错
】
11、 问题:实际气体和理想气体更接近的条件是( )。
选项:
A:高温高压
B:低温低压
C:高温低压
D:低温低压
答案: 【
高温低压
】
12、 问题:NH4NO3能溶于水,是一吸热过程,下列答案正确的是( )。
选项:
A:ΔG<0, ΔH>0, ΔS>0
B:ΔG>0, ΔH>0, ΔS>0
C:ΔG<0, ΔH>0, ΔS<0
D:ΔG<0, ΔH<0, ΔS>0
答案: 【
ΔG<0, ΔH>0, ΔS>0
】
13、 问题:封闭体系是指该体系与环境之间( )。
选项:
A:只有物质交换,没有能量交换
B:没有物质交换,只有能量交换
C:没有物质和能量交换
D:有物质和能量交换
答案: 【
没有物质交换,只有能量交换
】
14、 问题:有一个盛满热水的烧杯,当研究烧杯中的热水时,则此体系为( )。
选项:
A:封闭体系
B:绝热体系
C:敞开体系
D:孤立体系
答案: 【
敞开体系
】
15、 问题:对任一过程( )。
选项:
A:体系的内能变化与途径无关
B:体系所做的功与途径无关
C:体系所吸收的热量与途径无关
D:体系的焓与途径无关
答案: 【
体系的内能变化与途径无关
】
16、 问题:
下列反应中ΔS<0的反应为( )。
选项:
A:CO2(s) = CO2(g)
B:2H2O(l) = 2H2(g) + O2(g)
C:
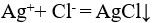
D:Na2S + 2HCl = H2S↑+ 2NaCl
答案: 【
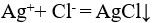
】
17、 问题:公式 Qp = ΔH 的适用条件是( )。
选项:
A:恒压过程
B:恒容过程
C:恒压须做体积功的过程
D:恒压不做非体积功的过程
答案: 【
恒压不做非体积功的过程
】
18、 问题:下列反应中,吉布斯函数变符合标准生成吉布斯函数定义的反应是( )。
选项:
A:1/2 H2(g) + 1/2 I2(g) = HI(g)
B:S(单斜) + O2(g) = SO2(g)
C:Na(s) + 1/2 Cl2(g) = NaCl(s)
D:2C(石墨) + O2(g) = 2CO(g)
答案: 【
Na(s) + 1/2 Cl2(g) = NaCl(s)
】
19、 问题:
已知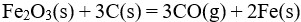 反应的
反应的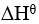 为正,
为正,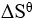 为正(假定
为正(假定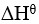 和
和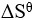 不随温度而变),下列说法正确的是( )。
不随温度而变),下列说法正确的是( )。
选项:
A:高温下自发过程,低温下非自发过程
B:低温下自发过程,高温下非自发过程
C:任何温度下均为自发过程
D:任何温度下均为非自发过程
答案: 【
高温下自发过程,低温下非自发过程
】
20、 问题:
在1173K,101.3kPa时,某反应的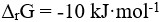 ,这表明( )。
,这表明( )。
选项:
A:该反应是自发反应
B:该反应在任何条件下均不自发
C:该反应是放热反应
D:该反应在1173K和101.3kPa条件下,反应是自发的
答案: 【
该反应在1173K和101.3kPa条件下,反应是自发的
】
第二章 单元测试
1、 问题:可逆吸热反应的平衡常数随温度升高而增大。( )
选项:
A:对
B:错
答案: 【
对
】
2、 问题:正催化剂能改变反应历程,降低反应活化能,但不能改变反应的标准吉布斯函数变。( )
选项:
A:对
B:错
答案: 【
对
】
3、 问题:只要温度不变,可逆反应反应物的平衡转化率就不变。( )
选项:
A:对
B:错
答案: 【
错
】
4、 问题:复杂反应机理的每一步反应必须是基元反应。( )
选项:
A:对
B:错
答案: 【
对
】
5、 问题:温度不变,增大浓度,活化分子百分数不变,活化分子浓度增大。( )
选项:
A:对
B:错
答案: 【
对
】
6、 问题:过渡态理论中,过渡态处于能量面的极大点,而中间体处于能量面的极小点。( )
选项:
A:对
B:错
答案: 【
对
】
7、 问题:化学反应级数可以是正数、负数或零。( )
选项:
A:对
B:错
答案: 【
对
】
8、 问题:升高温度,活化分子百分数不变,活化分子浓度增大。( )
选项:
A:对
B:错
答案: 【
错
】
9、 问题:某物质是某正反应的催化剂,也一定是该反应逆反应的催化剂。( )
选项:
A:对
B:错
答案: 【
对
】
10、 问题:反应级数和反应分子数不是一个概念。( )
选项:
A:对
B:错
答案: 【
对
】
11、 问题:
在密闭容器中盛有NO2气体,在等温下建立下列平衡:2NO2(红棕色)= N2O4(无色),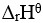 <0,若降低温度,则颜色将( )。
<0,若降低温度,则颜色将( )。
选项:
A:变深
B:变浅
C:不变
D:不一定
答案: 【
变浅
】
12、 问题:反应速率的质量作用定律只适用于( )。
选项:
A:化学反应式中各物质计量系数均为1的反应
B:一步完成的简单反应
C:实际能进行的反应
D:非基元反应
答案: 【
一步完成的简单反应
】
13、 问题:升高温度加快反应速率的主要原因是( )。
选项:
A:降低了反应的活化能
B:增加了分子的碰撞次数
C:提高了活化分子百分数
D:使平衡发生移动
答案: 【
提高了活化分子百分数
】
14、 问题:
一个化学反应达到平衡时,下列说法中正确的是( )。
选项:
A:各物质浓度或分压不随时间改变而改变
B:
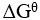 = 0
= 0
C:正、逆反应的速率常数相等
D:各反应物和生成物的浓度或分压相等
答案: 【
各物质浓度或分压不随时间改变而改变
】
15、 问题:下列说法错误的是( )。
选项:
A:反应速率的碰撞理论在气体分子运动论基础上提出的理论
B:1918年,Lewis提出反应速率的碰撞理论,Lewis是美国化学家
C:反应速率的过渡态理论又称活化配合物理论
D:反应速率的过渡态理论也称绝对反应速率理论
答案: 【
1918年,Lewis提出反应速率的碰撞理论,Lewis是美国化学家
】
16、 问题:下列说法错误的是( )。
选项:
A:对于一个基元反应,根据微观可逆原理,正逆反应经过同一个过渡态
B:一个基元反应,只对应一个过渡态
C:非基元反应多于一个过渡态
D:非基元反应的表观活化能不可能为负值
答案: 【
非基元反应的表观活化能不可能为负值
】
17、 问题:下列对于催化剂的描述,错误的是( )。
选项:
A:催化剂分正催化剂和负催化剂
B:催化剂能够影响化学反应的热力学性质
C:正催化剂能改变反应途径,降低反应的活化能,从而导致反应速率增大
D:催化剂具有选择性
答案: 【
催化剂能够影响化学反应的热力学性质
】
18、 问题:下列说法正确的是( )。
选项:
A:增加反应物的量,平衡正向移动
B:增大压力,平衡向气体分子数小的方向移动
C:加入催化剂,平衡向吸热反应方向移动
D:升高温度,正逆反应速率都增大
答案: 【
升高温度,正逆反应速率都增大
】
19、 问题:已知反应2SO2(g) + O2(g) = 2SO3(g)在某温度下达到平衡时气体的分压,SO2为22.4kPa,O2为33.0kPa,SO3为46.0kPa。则该温度下上述反应的标准平衡常数为( )。
选项:
A:0.0622
B:0.128
C:7.81
D:12.9
答案: 【
12.9
】
20、 问题:
某化学反应在298K时的标准自由能变为负值,则该温度时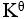 是( )。
是( )。
选项:
A:
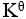 <1
<1
B:
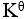 =1
=1
C:
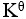 >1
>1
D:
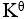 =
=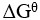
答案: 【
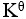 >1
>1
】
第三章 单元测试
1、 问题:
酸性水溶液中不含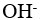 ,碱性水溶液中不含
,碱性水溶液中不含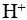 。( )
。( )
选项:
A:对
B:错
答案: 【
错
】
2、 问题:
将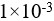
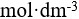 的HCl溶液稀释1000倍,则溶液的pH=8。( )
的HCl溶液稀释1000倍,则溶液的pH=8。( )
选项:
A:对
B:错
答案: 【
错
】
3、 问题:在一定温度下,改变溶液的pH,水的离子积不变。( )
选项:
A:对
B:错
答案: 【
对
】
4、 问题:
同浓度、等体积的HCl和HAc溶液,由于HAc解离出的H+浓度小,用NaOH滴定至化学计量点,HAc所需的NaOH量就少。( )
选项:
A:对
B:错
答案: 【
错
】
5、 问题:难溶电解质的溶解度大小可以根据难溶电解质的溶度积大小直接比较,即:溶度积较大的,溶解度较大;溶度积较小的,溶解度较小。( )
选项:
A:对
B:错
答案: 【
错
】
6、 问题:弱电解质的解离度随着溶液的稀释逐渐增大,解离出的离子浓度也会逐渐增大,解离常数也增大。( )
选项:
A:对
B:错
答案: 【
错
】
7、 问题:
1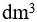 1.0
1.0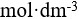 的NaOH溶液与0.1
的NaOH溶液与0.1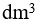 2.0
2.0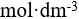 的
的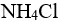 溶液混合即可作为缓冲溶液。( )
溶液混合即可作为缓冲溶液。( )
选项:
A:对
B:错
答案: 【
对
】
8、 问题:
在HAc-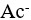 共轭酸碱对中,HAc为弱酸,
共轭酸碱对中,HAc为弱酸,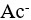 为强碱。( )
为强碱。( )
选项:
A:对
B:错
答案: 【
对
】
9、 问题:
一定温度下,AgCl水溶液中,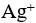 与
与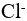 浓度的乘积是一个常数。( )
浓度的乘积是一个常数。( )
选项:
A:对
B:错
答案: 【
错
】
10、 问题:
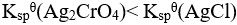 ,因此
,因此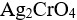 不会转化为AgCl。( ))
不会转化为AgCl。( ))
选项:
A:对
B:错
答案: 【
错
】
11、 问题:HAc溶液中加入少量的NaAc晶体,不发生变化的是( )。
选项:
A:溶液pH值
B:HAc的解离常数
C:HAc的解离度
D:HAc的浓度
答案: 【
HAc的解离常数
】
12、 问题:
配制pH=9.0的缓冲溶液,选择最佳缓冲对为( )。
选项:
A:

B:

C:

D:

答案: 【

】
13、 问题:
已知某温度下,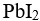 和
和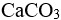 的
的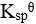 近似相等,则两者的溶解度( )。
近似相等,则两者的溶解度( )。
选项:
A:近似相等
B:
s(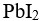 )<s(
)<s(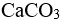 )
)
C:
s(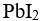 )>s(
)>s(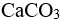 )
)
D:无法确定
答案: 【
s(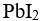 )>s(
)>s(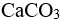 )
)
】
14、 问题:
根据酸碱质子理论,下列分子或离子为两性物质的是( )。
选项:
A:H2O
B:
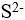
C:
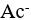
D:HCl
答案: 【
H2O
】
15、 问题:
AgCl在下列哪种溶液中的溶解度最小( )。
选项:
A:纯水
B:
0.001 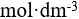
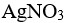
C:
0.001 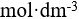
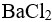
D:
0.001 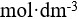 NaCl
NaCl
答案: 【
0.001 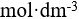
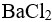
】
16、 问题:下列哪种条件下,缓冲溶液的缓冲容量较大( )。
选项:
A:pH值大
B:弱酸(或弱碱)的 pK值大
C:缓冲组分的浓度比值大
D:缓冲组分的浓度比接近1
答案: 【
缓冲组分的浓度比接近1
】
17、 问题:下列措施可以抑制FeCl3水解的是( )。
选项:
A:加热
B:加酸
C:加碱
D:加水稀释
答案: 【
加酸
】
18、 问题:
某溶液含有等浓度的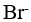 、
、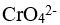 ,向此溶液中逐滴加入
,向此溶液中逐滴加入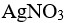 溶液时,已知:
溶液时,已知: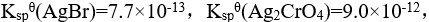 分步沉淀的顺序为( )。
分步沉淀的顺序为( )。
选项:
A:
AgBr,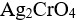
B:
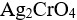 ,AgBr
,AgBr
C:共同沉淀
D:无法确定
答案: 【
AgBr,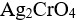
】
19、 问题:HgS可以溶于王水(浓HCl和浓HNO₃按体积比3:1混合)利用的是( )。
选项:
A:酸溶解法
B:氧化还原溶解法
C:配位溶解法
D:氧化还原溶解法和配位溶解法
答案: 【
氧化还原溶解法和配位溶解法
】
20、 问题:
已知: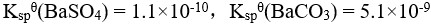 ,判断反应
,判断反应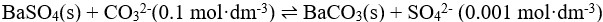 进行的方向( )。
进行的方向( )。
选项:
A:向右
B:向左
C:达到平衡
D:处于标准态
答案: 【
向右
】
21、 问题:
设0.10 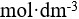 氢氰酸溶液的解离度为0.010%,则该温度下HCN的解离常数( )。
氢氰酸溶液的解离度为0.010%,则该温度下HCN的解离常数( )。
选项:
A:
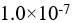
B:
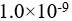
C:
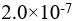
D:
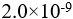
答案: 【
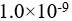
】
22、 问题:
向1 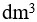 的0.10
的0.10 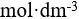 氨水溶液中加入
氨水溶液中加入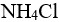 固体,M(
固体,M(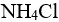 )=53.49,忽略体积变化,使溶液的pH=9.0,需要加入多少克( )。
)=53.49,忽略体积变化,使溶液的pH=9.0,需要加入多少克( )。
选项:
A:9.5
B:5.9
C:3.2
D:0.18
如有任何疑问请及时联系QQ 50895809

